HUKUM-HUKUM DASAR KIMIA
Hukum kekekalan massa sangat berpengaruh dalam ilmu kimia. Karena
faktanya beberapa reaksi kimia berlaku hukum kekekalan massa, walaupun
tidak semua. Dengan perkembangan ide-ide yang lebih ilmiah pada unsur,
senyawa dan campuran, orang mulai menyelidiki bagaimana dan mengapa zat
bereaksi. Kimiawan Prancis A. Lavoisier mencari dasar untuk penyelidikan
ilmiah materi dengan menjelaskan bahwa zat bereaksi dengan mengikuti
hukum-hukum tertentu. Undang-undang ini disebut hukum kombinasi kimia.
Hal kemudian menjadi dasar dari Teori Atom Dalton.
- Hukum Kekekalan Massa
Lavoiser menyimpulkan bahwa : jika suatu reaksi kimia dilakukan di ruang tertutup sehingga tidak ada zat-zat yang hilang, maka
massa zat-zat sebelum reaksi dan sesudah reaksi tidak berkurang atau tidak bertambah ( tetap ).
dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram
tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan
reaksi berjalan sempurna maka terjadi zat baru, yaitu tembaga ( II )
sulfida. Berapa massa zat baru tersebut ?
jawab :
ternyata massa zat baru tersebut sama dengan massa total zat-zat sebelum reaksi.
Bunyi Hukum Kekekalan Massa : ” Jumlah Massa Zat-Zat
Sebelum dan Sesudah Reaksi adalah Sama“
Contoh 1:
Jika 10 gram CaCO3 pada pemanasan menghasilkan 4,4 g CO2 dan 5,6 g CaO, hal ini sesuai dengan hukum kekekalan massa.
Solusi:
Massa reaktan = 10g
Mass dari produk = 4,4 g + 5,6 g = 10 g. Karena massa reaktan sama
dengan massa produk, pengamatan sesuai dengan hukum kekekalan massa.
- Hukum Perbandingan Tetap ( Hukum Proust )
Bunyi Hukum Perbandingan Tetap :
” Dalam Suatu Senyawa,
Perbandingan Massa Unsur-Unsur Penyusunnya Selalu Tetap
“
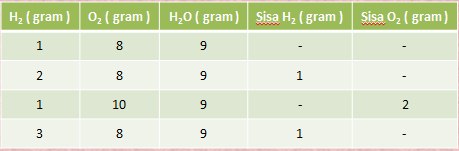
Pada percobaan 1 gram hidrogen dicampur dengan 8 gram oksigen
hasilnya ialah 9 gram air. Dan ternyata 8 gram oksigen hanya dapat
bereaksi dengan 1 gram hidrogen saja.
Data Percobaan Hidrogen dan Oksigen
- Hukum Perbandingan Berganda ( Hukum Dalton )
” Bila unsur-unsur dapat membentuk dua macam senyawa atau lebih,
dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan
massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan
bulat dan sederhana “
- Hukum Perbandingan Volume ( Hukum Gay Lussac )
” Pada temperatur dan tekanan yang sama,
perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi
merupakan perbandingan bilangan bulat dan sederhana “
- Hukum Boyle
Robert Boyle mengusulkan teori ini pada tahun 1662. Isinya adalah
hubungan antara tekanan, volume dan massa gas pada suhu konstan. Hukum
ini menyatakan bahwa volume (V) dari suatu massa gas berbanding terbalik
dengan tekanan (P) pada suhu konstan.
Secara matematis dapat dinyatakan sebagai,
atau PV = k = konstanta
Pada suhu tertentu, ketika tekanan gas berubah dari P1menjadi P2 maka hubungan menjadi
P1 V1 = P2 V2 = konstan
dimana V 2 adalah volume baru gas. Perkalian dari volume dan tekanan
untuk sebuah massa gas pada suhu konstan adalah konstan. Teori ini dapat
diuji secara eksperimental dengan mengambil data volume tekanan gas
seperti 10 g oksigen pada 25o C. Dari grafik dapat dilihat bahwa
peningkatan tekanan brakibat berkurangnya volume, tetapi perkalian 'PV'
tetap konstan. Data ini diplot dengan 'P' di sepanjang sumbu x dan
panjang 'V' sumbu y.
Pada grafik perkalian 'PV' dengan 1/V di sumbu x dan tekanan 'P' di
sumbu y, garis diagonal diperoleh yang menunjukkan 'PV' menjadi konstan
bahkan jika kita mengubah tekanan.
Kurva PV untuk gas berbeda pada temperatur yang berbeda. Plot 'PV'
melawan 'P' pada suhu yang berbeda dikenal sebagai isoterm. Kurva yang
lebih tinggi sesuai dengan suhu yang lebih tinggi. Hukum Boyle
mengungkapkan sifat kompresibel gas, yang memberikan ukuran kepadatan
yang meningkat.
Contoh soal
1. Suatu gas menempati volume 250 mL pada 745 mm Hg dan 25 o C.
Berapakah tekanan tambahan yang diperlukan untuk mengurangi volume gas
untuk 200ml pada konsentrasi yang sama?
Penyelesaian
P 1 = 745 mm Hg V 1 = 250 mL
P 2 =? V 2 = 200ml
P 1 V 1 = P 2 V 2
Tekanan tambahan yang dibutuhkan adalah 931,25-745 = 186,25 mm.
- Hukum Charles
Hukum
Charles dapat dinyatakan sebagai jika wadah ditempati oleh sampel gas
pada tekanan konstan maka volume berbanding lurus dengan suhu.
V / T = konstan
- V adalah volume
- T adalah temperatur (diukur dalam Kelvin)
Hukum Charles dapat disusun kembali menjadi dua persamaan berguna lainnya.
V1 / T1 = V2 / T2
- V1 adalah volume awal
- T1 adalah suhu awal
- V2 adalah volume akhir
- T2 adalah suhu akhir
V2 = V1 (T2 / T1)
- V2 adalah volume akhir
- T2 adalah suhu akhir
- V1 adalah volume awal
- T1 adalah suhu awal
- Hipotesis Avogadro
” gas-gas yang volumenya sama, jika diukur pada temperatur dan tekanan yang sama, mengandung jumlah molekul yang sama pula “
Avogadro menjelaskan percobaan Gay Lussac dengan menganggap partikel –
partikel gas tidak sebagai atom-atom, tetapi sebagai molekul-molekul.
Perbandingan volume gas-gas yang bereaksi dan gas-gas hasil reaksi jika diukur pada temperatur dan tekanan yang sama akan sesuai dengan perbandingan jumlah molekulnya, akan sama dengan perbandingan koefisien reaksinya.
Contoh Soal :
gas hidrogen direaksikan dengan gas oksigen
membentuk 8 liter ( T,P ) uap air. berapa liter gas hidrogen dan gas
oksigen dibutuhkan pada reaksi tersebut ?
Sumber :
http://mfyeni.wordpress.com/kelas-x/hukum-hukum-dasar-kimia/
http://www.ilmukimia.org/2012/12/penjelasan-hukum-boyle.html
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgtwUbiinVWWGfVUJ0V7owkvhvRNA9EgCIUQ8NJYptn2IzSAh78nUneHtCkmyxbpKiqRRiAOEpT4IqQ15wEttP3KBITYb4fL6Bt6sTt4fWgooacRNYguCPAPE-teUpfNMusjHkvtv58ufRa/s1600/Boyle.jpg
http://www.ilmukimia.org/2012/12/penjelasan-hukum-boyle.html
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgtwUbiinVWWGfVUJ0V7owkvhvRNA9EgCIUQ8NJYptn2IzSAh78nUneHtCkmyxbpKiqRRiAOEpT4IqQ15wEttP3KBITYb4fL6Bt6sTt4fWgooacRNYguCPAPE-teUpfNMusjHkvtv58ufRa/s1600/Boyle.jpg


















Tidak ada komentar:
Posting Komentar