REDOKS
Redoks (singkatan dari reaksi reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
 Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
- Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Berdasarkan perkembangannya, reaksi redoks dimulai dari pemahaman
batasan tradisional, yaitu reaksi oksidasi adalah reaksi pengikatan
oksigen, atau pelepasan hidrogen, atau pelepasan elektron. Sedangkan
sebaliknya, reaksi reduksi adalah reaksi pelepasan oksigen, atau
pengikatan hidrogen, atau pengikatan elektron. Batasan lain yaitu bahwa
reaksi oksidasi adalah reaksi penaikan bilangan oksidasi dan reaksi reduksi adalah reaksi penurunan bilangan oksidasi.
Kedua reaksi ini selalu terjadi secara bersamaan, serentak, artinya ada
spesies yang teroksidasi dan spesies lainnya tereduksi. Oleh karena itu,
lebih tepat dinyatakan sebagai rekasi reduksi-oksidasi atau disingkat
reaksi redoks.
Walaupun cukup tepat untuk digunakan dalam berbagai tujuan,
penjelasan di atas tidaklah persis benar. Oksidasi dan reduksi tepatnya
merujuk pada perubahan bilangan oksidasi karena transfer elektron yang sebenarnya tidak akan selalu terjadi. Sehingga oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi.
Dalam prakteknya, transfer elektron akan selalu mengubah bilangan
oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai
"redoks" walaupun tidak ada transfer elektron dalam reaksi tersebut
(misalnya yang melibatkan ikatan kovalen).
Reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge) dikenal sebagai reaksi metatesis.

Contoh Reaksi Redoks
 |
| Reaksi redoks terjadi antara logam tembaga dan larutan perak nitrat |
Dalam hal ini bilangan oksidasi tembaga naik dari 0 menjadi +2 dan bilangan oksidasi perak turun dari +1 menjadi 0. Tembaga mengalami oksidasi dan perak mengalami reduksi. Persamaan reaksi antara keduanya dapat dituliskan sebagai berikut:
Cu (s) + 2 AgNO3 (aq)  Cu(NO)3 (aq) + 2 Ag (s)
Cu(NO)3 (aq) + 2 Ag (s)
atau
Cu (s) + 2 Ag+ (aq)  Cu2+ (aq) + 2 Ag (s)
Cu2+ (aq) + 2 Ag (s)
Reaksi redoks ini sering dinyatakan dengan penulisan setengah reaksi secara terpisah, pelepasan elektron sebagai oksidasi dan penangkapan elektron sebagai reduksi:
Oksidasi: Cu (s)Cu2+ (aq) + 2 e
Reduksi: 2 Ag+ (aq) + 2 e2 Ag (s)
Reaksi redoks yang sedikit lebih rumit ditemui antara gas hidrogen sulfida dengan larutan ion besi(III) yang menghasilkan padatan belerang, ion besi(II) dan ion hidronium menurut persamaan reaksi:
H2S (g) + 2 Fe3+ (aq) + 2 H2O (l)  S (s) + 2 Fe2+ (aq) + 2 H3O+ (aq)
S (s) + 2 Fe2+ (aq) + 2 H3O+ (aq)
Dalam reaksi tersebut, besi telah mengalami reduksi dari +3 menjadi +2 dan belerang mengalami oksidasi dari -2 menjadi nol, Jadi persamaan redoks tersebut dapat dipisahkan menjadi dua setengah reaksi sebagai berikut:
Oksidasi: H2S (g) + 2 H2O (l)S (s) + 2 H3O+ (aq) + 2 e
Reduksi: 2 Fe3+ (aq) + 2 e2 Fe2+ (aq)
Oksidator dan reduktor
Senyawa-senyawa yang memiliki kemampuan untuk mengoksidasi senyawa lain dikatakan sebagai oksidatif dan dikenal sebagai oksidator atau agen oksidasi.
Oksidator melepaskan elektron dari senyawa lain, sehingga dirinya
sendiri tereduksi. Oleh karena ia "menerima" elektron, ia juga disebut
sebagai penerima elektron. Oksidator bisanya adalah senyawa-senyawa yang memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti H2O2, MnO4−, CrO3, Cr2O72−, OsO4) atau senyawa-senyawa yang sangat elektronegatif, sehingga dapat mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah senyawa (misalnya oksigen, fluorin, klorin, dan bromin).
Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikatakan sebagai reduktif dan dikenal sebagai reduktor atau agen reduksi.
Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri
teroksidasi. Oleh karena ia "mendonorkan" elektronnya, ia juga disebut
sebagai penderma elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logam-logam ini akan memberikan elektronnya dengan mudah. Reduktor jenus lainnya adalah reagen transfer hidrida, misalnya NaBH4 dan LiAlH4), reagen-reagen ini digunakan dengan luas dalam kimia organik, terutama dalam reduksi senyawa-senyawa karbonil menjadi alkohol. Metode reduksi lainnya yang juga berguna melibatkan gas hidrogen (H2) dengan katalis paladium, platinum, atau nikel, Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbon-karbon.
Cara yang mudah untuk melihat proses redoks adalah, reduktor
mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor
melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron
dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam
sebuah reaksi disebut sebagai pasangan redoks.
Contoh reaksi redoks
Salah satu contoh reaksi redoks adalah antara hidrogen dan fluorin:
Kita dapat menulis keseluruhan reaksi ini sebagai dua reaksi setengah: reaksi oksidasi
dan reaksi reduksi
Penganalisaan masing-masing reaksi setengah akan menjadikan
keseluruhan proses kimia lebih jelas. Karena tidak terdapat perbuahan
total muatan selama reaksi redoks, jumlah elektron yang berlebihan pada
reaksi oksidasi haruslah sama dengan jumlah yang dikonsumsi pada reaksi
reduksi.
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki
bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari
bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari
bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
Dan ion-ion akan bergabung membentuk hidrogen fluorida:
Reaksi penggantian
Redoks terjadi pada reaksi penggantian tunggal atau reaksi substitusi.
Komponen redoks dalam tipe reaksi ini ada pada perubahan keadaan
oksidasi (muatan) pada atom-atom tertentu, dan bukanlah pada pergantian
atom dalam senyawa.
Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:
Persamaan ion dari reaksi ini adalah:
Terlihat bahwa besi teroksidasi:
dan tembaga tereduksi:
Contoh-contoh lainnya
- Besi(II) teroksidasi menjadi besi(III)
- hidrogen peroksida tereduksi menjadi hidroksida dengan keberadaan sebuah asam:
- H2O2 + 2 e− → 2 OH−
Persamaan keseluruhan reaksi di atas adalah:
- 2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
- denitrifikasi, nitrat tereduksi menjadi nitrogen dengan keberadaan asam:
- 2NO3− + 10e− + 12 H+ → N2 + 6H2O
- Besi akan teroksidasi menjadi besi(III) oksida dan oksigen akan tereduksi membentuk besi(III) oksida (umumnya dikenal sebagai perkaratan):
- 4Fe + 3O2 → 2 Fe2O3
- Pembakaran hidrokarbon, contohnya pada mesin pembakaran dalam, menghasilkan air, karbon dioksida, sebagian kecil karbon monoksida, dan energi panas. Oksidasi penuh bahan-bahan yang mengandung karbon akan menghasilkan karbon dioksida.
- Dalam kimia organik, oksidasi seselangkah (stepwise oxidation) hidrokarbon menghasilkan air, dan berturut-turut alkohol, aldehida atau keton, asam karboksilat, dan kemudian peroksida.
Reaksi redoks dalam industri
Proses utama pereduksi bijih logam untuk menghasilkan logam didiskusikan dalam artikel peleburan.
Oksidasi digunakan dalam berbagai industri seperti pada produksi produk-produk pembersih.
Reaksi redoks juga merupakan dasar dari sel elektrokimia.
- Reaksi redoks dalam biologi
Banyak proses biologi yang melibatkan reaksi
redoks. Reaksi ini berlangsung secara simultan karena sel, sebagai tempat berlangsungnya reaksi-reaksi biokimia,
harus melangsungkan semua fungsi hidup. Agen biokimia yang mendorong
terjadinya oksidasi terhadap substansi berguna dikenal dalam ilmu pangan dan kesehatan sebagai oksidan. Zat yang mencegah aktivitas oksidan disebut antioksidan.
Pernapasan sel, contohnya, adalah oksidasi glukosa (C6H12O6) menjadi CO2 dan reduksi oksigen menjadi air. Persamaan ringkas dari pernapasan sel adalah:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
- Proses pernapasan sel juga sangat bergantung pada reduksi NAD+ menjadi NADH dan reaksi baliknya (oksidasi NADH menjadu NAD+). Fotosintesis secara esensial merupakan kebalikan dari reaksi redoks pada pernapasan sel:
- 6 CO2 + 6 H2O + light energy → C6H12O6 + 6 O2
Siklus redoks
Berbagai macam senyawa aromatik direduksi oleh enzim untuk membentuk senyawa radikal bebas. Secara umum, penderma elektronnya adalah berbagai jenis flavoenzim dan koenzim-koenzimnya. Seketika terbentuk, radikal-radikal bebas anion ini akan mereduksi oskigen menjadi superoksida.
Reaksi bersihnya adalah oksidasi koenzim flavoenzim dan reduksi oksigen
menjadi superoksida. Tingkah laku katalitik ini dijelaskan sebagai
siklus redoks.
Contoh molekul-molekul yang menginduksi siklus redoks adalah herbisida parakuat, dan viologen dan kuinon lainnya seperti menadion.
Menyeimbangkan reaksi redoks
Untuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH-, H2O, dan elektron untuk menutupi perubahan oksidasi.
Media asam
Pada media asam, ion H+ dan air ditambahkan pada reaksi setengah untuk menyeimbangkan keseluruhan reaksi. Sebagai contoh, ketika mangan(II) bereaksi dengan natrium bismutat:
Reaksi ini diseimbangkan dengan mengatur reaksi sedemikian rupa
sehingga dua setengah reaksi tersebut melibatkan jumlah elektron yang
sama (yakni mengalikan reaksi oksidasi dengan jumlah elektron pada
langkah reduksi, demikian juga sebaliknya).
Reaksi diseimbangkan:
Hal yang sama juga berlaku untuk sel bahan bakar propana di bawah kondisi asam:
Dengan menyeimbangkan jumlah elektron yang terlibat:
Persamaan diseimbangkan:
Media basa
Pada media basa, ion OH- dan air ditambahkan ke reaksi setengah untuk menyeimbangkan keseluruhan reaksi.Sebagai contoh, reaksi antara kalium permanganat dan natrium sulfit:
Dengan menyeimbangkan jumlah elektron pada kedua reaksi setengah di atas:
Persamaan diseimbangkan:














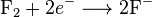

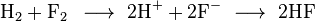







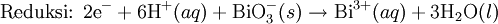

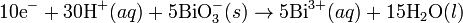
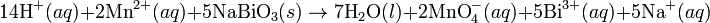

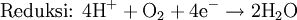
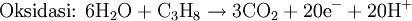






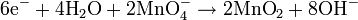


Tidak ada komentar:
Posting Komentar