PERHITUNGAN KIMIA
Mengapa kita harus mempelajari stoikiometri? Salah satu alasannya,
karena mempelajari ilmu kimia tidak dapat dipisahkan dari melakukan
percobaan di laboratorium. Adakalanya di laboratorium kita harus
mereaksikan sejumlah gram zat A untuk menghasilkan sejumlah gram zat B.
Pertanyaan yang sering muncul adalah jika kita memiliki sejumlah gram
zat A, berapa gramkah zat B yang akan dihasilkan? Untuk menjawab
pertanyaan itu kita memerlukan stoikiometri.
Stoikiometri erat kaitannya dengan perhitungan kimia. Untuk
menyelesaikan soal-soal perhitungan kimia digunakan asas-asas
stoikiometri yaitu antara lain persamaan kimia dan konsep mol. Pada
pembelajaran ini kita akan mempelajari terlebih dahulu mengenai
asas-asas stoikiometri, kemudian setelah itu kita akan mempelajari
aplikasi stoikiometri pada perhitungan kimia beserta contoh soal dan
cara menyelesaikannya.
A. Penentuan Volume Gas Pereaksi dan Hasil Reaksi
Pertanyaan yang timbul setelah Gay Lussac mengemukakan hukum
perbandingan volume dapat dipecahkan oleh seorang ahli fisika Italia yang
bernama Amadeo Avogadro pada tahun 1811.
Menurut Avogadro:
”Gas-gas yang volumenya sama, jika diukur pada suhu dan tekanan yang
sama, akan memiliki jumlah molekul yang sama pula”.
Gambar
Ilustrasi percobaan Avogadro, pembentukan dua molekul uap air dari reaksi antara dua
molekul gas hidrogen dan satu molekul gas oksigen
Ilustrasi percobaan Avogadro, pembentukan dua molekul uap air dari reaksi antara dua
molekul gas hidrogen dan satu molekul gas oksigen
Oleh karena perbandingan volume gas hidrogen, gas oksigen, dan uap air
pada reaksi pembentukan uap air = 2 : 1 : 2 maka perbandingan jumlah molekul
hidrogen, oksigen, dan uap air juga 2 : 1 : 2. Jumlah atom tiap unsur tidak
berkurang atau bertambah dalam reaksi kimia. Oleh karena itu, molekul gas
hidrogen dan molekul gas oksigen harus merupakan molekul dwiatom,
sedangkan molekul uap air harus merupakan molekul triatom.
Perbandingan volume gas dalam suatu reaksi sesuai dengan koefisien reaksi
gas-gas tersebut. Hal ini berarti bahwa, jika volume salah satu gas diketahui,
volume gas yang lain dapat ditentukan dengan cara membandingkan koefisien
reaksinya.
Contoh:
Pada reaksi pembentukan uap air.
2H2(g) + O2(g) –> 2H2O(g)
Jika volume gas H2 yang diukur pada suhu 25°C dan tekanan 1 atm
sebanyak 10 L volume gas O2 dan H2O pada tekanan dan suhu yang sama
dapat ditentukan dengan cara sebagai berikut.
Volume H2 : Volume O2 = Koefisien H2 : Koefisien O2
B. Massa Atom
- Relatif dan Massa Molekul Relatif
Setelah ditemukan peralatan yang sangat peka di awal abad XX, para
ahli kimia melakukan percobaan tentang massa satu atom. Sebagai contoh,
dilakukan percobaan untuk mengukur.
1. massa satu atom H = 1,66 –> 10–24 g
2. massa satu atom O = 2,70 –> 10–23 g
3. massa satu atom C = 1,99 –> 10–23 g
Dari data di atas dapat dilihat bahwa massa satu atom sangat kecil. Para
ahli sepakat menggunakan besaran Satuan Massa Atom (sma) atau Atomic
Massa Unit (amu) atau biasa disebut juga satuan Dalton. Pada materi
struktur atom,
Anda telah mempelajari juga bahwa atom sangatlah kecil, oleh karena itu tidak mungkin menimbang atom dengan menggunakan neraca.
- Massa Molar Massa Atom Relatif Massa Molekul Relatif
1. Massa Molar
Berdasarkan definisi SI tentang mol, Tetapan Avogadro dari atom-atom
karbon-12 akan diperoleh jika kita menimbang secara tepat 12 g isotop
C-12. Karena karbon terdapat di alam dalam campuran dua isotop C-12 dan
C-13 maka masanya merupakan massa rata-rata kedua isotop tersebut, yaitu
sebesar 12,011 sma, sehingga sejumlah tetapan Avogadro atom C akan
diperoleh jika kita mengambil 12,011 g karbon-12. Jadi, 1 mol karbon
memiliki massa 12,011 g. Hal ini berlaku juga untuk unsur lainnya yaitu:
Satu mol unsur mempunyai massa yang besarnya sama dengan massa atom
unsur tersebut dalam gram. Massa 1 mol zat disebut dengan massa molar.
Untuk zat yang tersusun dari kumpulan atom (molekul) atau merupakan
pasangan ion-ion maka massa 1 mol zat tersebut sama dengan massa molekul
relatif atau massa rumus relatif zat tersebut dalam gram. Massa molekul
relatif dan massa rumus relatif suatu senyawa dapat diketahui dari
penjumlahan massa atom relatif unsur-unsur penyusun senyawanya.
Menurutmu, berapakah massa molar dari H2O dan NaCl?
ke atas
2. Massa Atom Relatif (Ar)
Massa atom unsur sebenarnya belum dapat diukur dengan alat penimbang
massa atom, karena atom berukuran sangat kecil. Massa atom unsur
ditentukan dengan cara membandingkan massa atom rata-rata unsur tersebut
terhadap 1/12 massa rata-rata satu atom karbon 12 sehingga massa atom
yang diperoleh adalah massa atom relatif (Ar).
Para ahli menggunakan isotop karbon C–12 sebagai standar dengan massa
atom relatif sebesar 12. Massa atom relatif menyatakan perbandingan
massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C–12.
Atau dapat dituliskan:
1 satuan massa atom (amu) = 1/12 massa 1 atom C–12
Contoh:
Massa atom rata-rata oksigen 1,33 kali lebih besar dari pada massa atom karbon –12.
Maka: Ar O = 1,33 –> Ar C–12
= 1,33 –> 12
= 15,96
Para ahli membandingkan massa atom yang berbeda-beda, menggunakan skala massa atom relatif dengan lambang ”Ar”.
Para ahli memutuskan untuk menggunakan C–12 atau isotop 12C karena
mempunyai kestabilan inti yang inert dibanding atom lainnya. Isotop atom
C–12 mempunyai massa atom 12 sma. Satu sma sama dengan 1,6605655 x
10–24 g. Dengan digunakannya isotop 12C sebagai standar maka dapat ditentukan massa atom unsur yang lain.
Massa atom relatif suatu unsur (Ar) adalah bilangan yang menyatakan
perbandingan massa satu atom unsur tersebut dengan 1/12 massa satu atom C–12.
ArX = ( massa atom rata – rata X ) / ( 1/2 massa atom karbon – 12 )
Tabel Massa Beberapa Isotop
Jika diketahui massa 1 atom oksigen 2,70 x 10–23 g, berapakah Ar atom O jika
massa atom C 1,99 x 10–23 g?
Jawab:
Besarnya harga Ar juga ditentukan oleh harga rata-rata isotop
tersebut. Sebagai contoh, di alam terdapat 35Cl dan 37Cl dengan
perbandingan 75% dan 25% maka Ar Cl dapat dihitung dengan cara:
Ar Cl = (75% x 35) + (25% x 37) = 35,5
Ar merupakan angka perbandingan sehingga tidak memiliki satuan. Ar dapat
dilihat pada Tabel Periodik Unsur (TPU) dan selalu dicantumkan dalam
satuan soal apabila diperlukan.
3. Massa Molekul Relatif (Mr)
Unsur dan senyawa yang partikelnya berupa molekul, massanya
dinyatakan dalam massa molekul relatif (Mr). Pada dasarnya massa molekul
relatif (Mr) adalah perbandingan massa rata-rata satu molekul unsur
atau senyawa dengan 1/12 massa rata-rata satu atom karbon-12.
Jenis molekul sangat banyak, sehingga tidak ada tabel massa molekul
relatif. Akan tetapi, massa molekul relatif dapat dihitung dengan
menjumlahkan massa atom relatif atom-atom pembentuk molekulnya.
Mr = ∑Ar
Untuk senyawa yang partikelnya bukan berbentuk molekul, melainkan
pasangan ion-ion, misalnya NaCl maka Mr senyawa tersebut disebut massa
rumus relatif. Massa rumus relatif dihitung dengan cara yang sama dengan
seperti perhitungan massa molekul relatif, yaitu dengan menjumlahkan
massa atom relatif unsur-unsur dalam rumus senyawa itu.
Molekul merupakan gabungan dari beberapa unsur dengan perbandingan
tertentu. Unsur-unsur yang sama bergabung membentuk molekul unsur,
sedangkan unsur-unsur yang berbeda membentuk molekul senyawa. Massa
molekul unsur atau senyawa dinyatakan oleh massa molekul (Mr). Massa
molekul relatif adalah perbandingan massa molekul unsur atau senyawa terhadap 1/12 x massa atom C–12. Secara matematis dapat dinyatakan:
- Tetapan Avogadro
Kesetaraan Stoikiometri
Jika kita ingin membuat suatu zat kita harus mengetahui rumus kimia
zat tersebut. Rumus kimia menunjukkan perbandingan atom unsur-unsur yang
menyusun suatu zat. Dengan mengetahui rumus kimia zat tersebut, kita
dapat mereaksikan pereaksi-pereaksi sedemikian sehingga zat yang
terbentuk memiliki perbandingan atom unsur-unsur penyusunnya yang sesuai
dengan rumus kimianya.
Perbandingan atom unsur-unsur dalam suatu rumus kimia ditunjukkan
dengan angka yang bulat, dan bukan dengan angka pecahan. Sebagai contoh,
karbonmonoksida (CO) mempunyai perbandingan antara atom C dan atom O
sama dengan 1 : 1, yang berarti perbandingan atom untuk membuat 1
molekul CO tanpa ada sisa atom C atau atom O kita harus mengambil 1 atom
C dan 1 atom O sesuai dengan perbandingan atom-atom dalam rumus kimia
senyawanya.
1 atom C + 1 atom O → 1 molekul CO
Untuk membuat 1 lusin molekul CO, kita harus mengambil 1 lusin atom C dan 1 lusin atom O sesuai dengan perbandingan atom 1: 1.
1 lusin atom C + 1 lusin atom O → 1 lusin molekul CO
Untuk membuat 1 gross (144) molekul CO, persamaannya akan menjadi:
1 gross atom C + 1 gross atom O → 1 gross molekul CO
Jadi apapun satuan jumlah atom yang digunakan, yang terpenting adalah perbandingan atom C dan atom O sama, yaitu 1 : 1.
Berdasarkan analisa, kelihatannya mudah untuk melakukan reaksi kimia
yang dapat meminimalisasi adanya atom yang tersisa. Caranya adalah
dengan menghitung jumlah jenis atom yang akan direaksikan secara cermat,
dan diukur dalam perbandingan yang diinginkan, seperti contoh di atas.
Masalahnya, atom atau molekul terlalu kecil untuk dihitung secara
langsung. Oleh karena itu kita harus mengambil satuan jumlah yang lebih
besar dari lusin maupun gross. Satuan Internasional (SI) mendefinisikan
satuan dasar untuk jumlah zat kimia yang disebut mol.
Satu mol unsur atau senyawa memiliki jumlah partikel yang dinyatakan
oleh rumus kimianya, yang sama dengan jumlah atom yang terdapat dalam 12
gram C-12. Jumlah atom pada 12 gram karbon-12 disebut tetapan Avogadro,
dinyatakan dengan lambang L, harga tetapan Avogadro diketahui sebanyak
6,022×1023. Sesuai dengan definisi 1 mol di atas, maka 1 mol zat
mengandung 6,022×1023 partikel zat tersebut. Satu mol H2O memiliki
molekul H2O sebanyak tetapan Avogadro. Satu mol karbon memiliki atom
karbon sebanyak tetapan Avogadro. Dengan demikian dapat digeneralisasi
bahwa jumlah mol suatu zat berarti mengandung jumlah mol yang sama dari
satuan rumus zat tersebut. Generalisasi tersebut merupakan inti dari
stoikiometri.
Apabila Anda mereaksikan satu atom karbon (C) dengan satu molekul
oksigen (O2) maka akan terbentuk satu molekul CO2. Tetapi sebenarnya
yang Anda reaksikan bukan satu atom karbon dengan satu molekul oksigen,
melainkan sejumlah besar atom karbon dan sejumlah besar molekul oksigen.
Oleh karena jumlah atom atau jumlah molekul yang bereaksi begitu
besarnya maka untuk menyatakannya, para ahli kimia menggunakan ”mol”
sebagai satuan jumlah partikel (molekul, atom, atau ion).
Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel
zat itu sebanyak atom yang terdapat dalam 12,000 g atom karbon –12.
Jadi, dalam satu mol suatu zat terdapat 6,022 x 1023 partikel. Nilai
6,022 x 1023 partikel per mol disebut sebagai tetapan Avogadro, dengan
lambang L atau N. Dalam kehidupan sehari-hari, mol dapat dianalogikan
sebagai ”lusin”. Jika lusin
menyatakan jumlah 12 buah, mol menyatakan jumlah 6,022 x 10 23 partikel
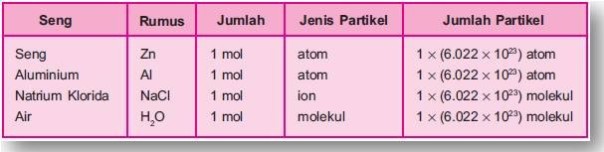
zat. Kata partikel pada NaCl, H2O, dan N2 dapat dinyatakan dengan ion
dan molekul, sedangkan pada unsur seperti Zn, C, dan Al dapat dinyatakan
dengan atom.
Perhatikan tabel berikut!
Tabel Jumlah Partikel dalam Beberapa Zat
Rumus kimia suatu senyawa menunjukkan perbandingan jumlah atom yang ada dalam senyawa tersebut.
Tabel Perbandingan Atom-Atom dalam H2SO4
Contoh Soal
Kesetaraan stoikiometri antara unsur-unsur dalam satuan rumus
misalnya molekul, adalah perbandingan atom atau perbandingan mol dalam
satuan rumus tersebut. Konsep mol dapat digunakan untuk menggambarkan
perbandingan atom dalam senyawa, misalnya molekul air, H2O. Subskrip
dalam rumus kimia molekul H2O memberikan informasi bahwa perbandingan
atom H dengan atom O dalam air adalah 2 atom H setara dengan 1 atom O
atau jika dinyatakan dalam satuan lusin dan mol berturut-turut adalah 2
lusin atom H setara dengan 1 lusin atom O dan 2 mol atom H setara dengan
1 mol atom O.
Kita dapat melihat bahwa dalam semua satuan perbandingan tersebut,
perbandingan stoikiometrinya selalu 2 : 1. Kesetaraan stoikiometri
antara atom H dan atom O dalam senyawa H2O adalah 2 mol atom H setara
dengan 1 mol atom O. Kesetaraan dilambangkan dengan tanda ~. Kesetaraan
secara stoikiometri antar unsur-unsur dalam senyawa H2O dapat
digambarkan sebagai berikut :
1 mol molekul H2O ~ 2 mol atom H
1 mol molekul H2O ~ 1 mol atom O
1 mol atom O ~ 2 mol atom H
Kesetaraan tersebut dapat digunakan sebagai faktor konversi sehingga
dapat digunakan untuk menyelesaikan soal-soal dalam perhiotungan
stoikiometri.
Dalam ilmu kimia, mol adalah satuan pengukuran jumlah yang standar.
Ketika kita mereaksikan zat-zat tertentu, zat-zat tersebut bereaksi
dengan perbandingan mol yang bulat dan sederhana, tetapi kita tidak bisa
mengukur jumlah zat-zat tersebut secara langsung dengan neraca karena
neraca hanya bisa dibaca dalam satuan massa, neraca tidak dapat dibaca
dalam satuan kimia yaitu mol.
Masalahnya adalah kita membandingkan jumlah satu zat dengan zat
lainnya dengan menggunakan satuan kimia yaitu mol, sementara untuk
bekerja di laboratorium kita tidak bisa menggunakan mol melainkan dengan
satuan massa yaitu gram. Bagaimana cara mengatasi masalah tersebut?
Caranya adalah kita harus mengubah mol ke gram.
Sesuai definisi massa molar unsur atau senyawa, dimana 1 mol unsur
atau senyawa akan diperoleh jika kita menimbang unsur atau senyawa
tersebut sebesar massa atom relatif atau massa rumus relatifnya dalam
gram. Oleh karena itu, kita memerlukan data massa molar zat tersebut
untuk bisa mengubah mol zat tersebut ke gram. Begitupun sebaliknya jika
kita harus menghitung jumlah mol dari gram suatu zat kita juga dapat
menggunakan data massa molar.
Berapakah massa dari 0,5 mol Oksigen (O2)?
Pertanyaan tersebut dapat dinyatakan kembali sebagai berikut:
? g O2 ~ 0,5 mol O2
Massa atom relatif O = 16
Sesuai dengan definisi SI maka 1 mol O2 = (2×16) g O2
Jadi 0.5 mol O2 = 16 g O2
Berapa mol silikon dalam 4,6 g Si?
Pertanyaan tersebut dapat dinyatakan kembali sebagai berikut:
4,6 g Si ~ ? mol Si
Massa atom relatif Si= 28,09 sesuai dengan definisi SI maka 1 mol Si ~ 28,09 g Si
1 mol Si = 28,09 g Si
Sehingga bila kita mengalikan gram Si yang diberikan (4,6 g Si) dengan faktor konversi yang pertama akan didapatkan:
Jadi 4,6 g Si = 0.164 mol Si
Hukum perbandingan tetap merupakan hukum yang mengendalikan penulisan
rumus kimia baik berupa rumus empiris maupun rumus molekul. Rumus
empiris senyawa dapat ditentukan berdasarkan persentase massa
unsur-unsur yang membentuk senyawa itu. Oleh karena kita mengetahui
massa molar masing-masing unsur, maka dari perbandingan massa unsur
dalam senyawa kita dapat menarik kesimpulan tentang perbandingan mol
unsur-unsur dalam senyawa. Perbandingan mol mencerminkan pula
perbandingan jumlah atom, sehingga kita dapat menghitung perbandingan
jumlah atom unsur-unsur dalam senyawa berdasarkan perbandingan massa
unsur-unsur dalam senyawa.
Rumus molekul menggambarkan jumlah atom sebenarnya dari tiap unsur
dalam molekul suatu senyawa. Rumus molekul merupakan kelipatan bulat
(kelipatan satu, dua, tiga, empat, dan seterusnya) dari rumus empiris.
Oleh karena itu, rumus molekul suatu senyawa dapat dituliskan sebagai
(RE)x, dengan RE sebagai rumus empiris dan x sebagai bilangan bulat.
Rumus molekul senyawa baru dapat ditentukan apabila nilai x diketahui.
Penentuan nilai x memerlukan data massa molekul relatif senyawa yang
diperoleh dari percobaan.
Dari hasil analisis kimia yang dilakukan ditemukan bahwa cuplikan
(contoh) senyawa yang bernama Hidrazin terdiri atas 87,42 % massa N dan
12,58 % massa H. Bagaimanakah rumus empiris dan rumus molekulnya?
Persen massa tersebut merupakan massa N dan H jika kita mengambil 100
g cuplikan hidrazin, sehingga dalam cuplikan itu terdapat 87,42 g
nitrogen dan 12,58 g hidrogen. Tetapi subskrip dalam molekul hidrazin
menunjukkan perbandingan mol sehingga kita harus mengubah massa ke mol.
Massa atom N adalah 14, dan 1 untuk H. Massa atom masing–masing unsur
ini dapat digunakan untuk membuat faktor konversi. Perhitungan molnya
adalah sebagai berikut:
Hasil perhitungan ini menunjukkan bahwa perbandingan jumlah mol atom N
dan jumlah atom H dalam hidrazin 6,24:12,58. perandingan bilangan
bulatnya adalah 1:2. dengan demikian rumus empiris hidrazin adalah NH2
Apakah rumus molekul hidrazin?
Rumus molekul menggambarkan jumlah atom tiap unsur dalam molekul
senyawa. Rumus molekul merupakan kelipatan bulat (kelipatan satu, dua,
tiga, empat, dan seterusnya) dari rumus empiris. Oleh karena itu, rumus
molekul hidrazin dapat dituliskan sebagai (NH2)x, dengan x sebagai
bilangan bulat. Rumus molekul hidrazin baru dapat ditentukan apabila
nilai x diketahui. Penentuan nilai x memerlukan data massa molekul
relatif senyawa yang diperoleh dari percobaan. Hasil percobaan
menunjukkan bahwa Mr(Hidrazin) = 32. Oleh karena itu, massa molekul
relatif hidrazin dapat pula diungkapkan sebagai berikut:
Mr(Hidrazin) = x [Ar(N) + 2Ar(H)]
32 = 16x
x = 2
Dengan demikian, rumus molekul hidrazin merupakan kelipatan dua dari
rumus empiris hidrazin (NH2). Kesimpulannya adalah rumus molekul
hidrazin adalah N2H4.
Mol zat-zat dalam suatu persamaan kimia dapat dihitung berdasarkan
kesetaraan stoikiometrinya. Dengan demikian, kita dapat memperkirakan
berapa mol produk yang akan dihasilkan dari sejumlah tertentu mol
pereaksi yang digunakan.
Bila kita memiliki 2 mol Nitrogen (N2) direaksikan dengan Hidrogen (H2) secukupnya, berapa mol Amonia (NH3) akan dihasilkan?
Diketahui persamaan kimia N2 + 3 H2 → 2 NH3
Pertanyaan tersebut dapat dinyatakan kembali sebagai berikut:
2 mol N2 ~ ? mol NH3
kesetaraan mol secara stoikiometri: 1 mol N2 ~ 2 mol NH3
1 mol molekul N2 = 2 mol molekul NH3
Maka 2 mol N2 = 4 mol molekul NH3
jadi 2 mol N2 = 4 mol NH3
Perhitungan massa zat yang terlibat dalam reaksi kimia merupakan
salah satu pertanyaan yang dihadapi oleh para ahli kimia di
laboratorium. Jika kita memiliki sejumlah gram tertentu pereaksi A,
berapakah gram pereaksi B yang harus direaksikan dan berapa gram produk
yang akan dihasilkan?
Jawaban pertanyaan tersebut dapat digambarkan dalam diagram alur penyelesaian soal sebagai berikut:
Berapa gram Klor (Cl2) dapat dibuat dari penguraian 64 gram Emas(III)
Klorida (AuCl3), dengan persamaan kimia: 2 AuCl3 → 2 Au + 3 Cl2
Dari soal diketahui bahwa satuan jumlah zat yang digunakan adalah
gram, sedangkan pada prinsip perhitungan kimia yang paling dasar
digunakan satuan mol. Oleh karena itu pertama-tama kita harus
mengkonversi dari gram ke mol, selanjutnya jumlah mol tersebut digunakan
untuk mencari ekivalensi jumlah mol zat-zat dalam reaksi. Untuk
mendapatkan hasil akhirnya, kita harus mengkonversi jumlah mol klorin
dalam satuan gram.
1 mol AuCl3 ~ 203,5 gram AuCl3
kesetaraan tersebut menjadi faktor konversi 1 mol AuCl3/203,5 gram atau 203,5 gram/1 mol AuCl3
Untuk mendapatkan jumlah mol AuCl3 yang terurai, kita dapat
mengalikan dalam satu faktor konversi di atas dengan jumlah gram AuCl3
yang diketahui.
Faktor konversi yang digunakan adalah massa rumus molekul AuCl3 yaitu
203,5 sehingga 64 gram AuCl3 dapat diterjemahkan dalam satuan mol
sebagai berikut:
Koefisien dalam persamaan reaksi menunjukkan ekivalensi stoikiometri
antara AuCl3 dan Cl2, yaitu 2 mol AuCl3 ~ 3 mol Cl2 maka 0,314 mol AuCl3
setara dengan 3/2 x 0,314 mol = 0,472 mol Cl2. Untuk mengetahui berapa
jumlah gram Cl2 yang dihasilkan, maka kita harus mengkonversi jumlah mol
Cl2 ke dalam satuan gram. Jika diketahui rumus massa molekul Cl2 adalah
70, maka perhitungannya adalah sebagai berikut:
Jadi klorin yang dapat terbentuk dari penguraian 64 gram AuCl3 adalah sebanyak 33,02 gram.
Jika kita mereaksikan zat-zat dengan jumlah sembarang dalam suatu
reaksi kimia, sangat mungkin satu pereaksi habis terlebih dahulu
sedangkan pereaksi yang lain tersisa. Pereaksi yang habis terlebih
dahulu dinamakan pereaksi pembatas. Kita dapat memperkirakan jumlah
maksimal produk yang akan dihasilkan berdasarkan perbandingan
stoikiometri zat-zat dalam reaksi dan pereaksi pembatasnya.
Sumber :






















Tidak ada komentar:
Posting Komentar